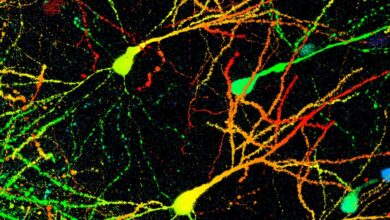
Научници са Универзитета Нортхвестерн креирали су најсофистициранији модел до сада узгојен у лабораторији за проучавање повреда кичмене мождине код људи.
У новом истраживању, тим је радио са људским органоидима кичмене мождине – минијатурним органима добијеним од матичних ћелија – да би поново створио различите облике трауме кичмене мождине и проценио обећавајући регенеративни третман.
По први пут, истраживачи су показали да ови људски органоиди кичмене мождине могу верно да репродукују главне биолошке последице повреде кичмене мождине. Модел је показао ћелијску смрт, упалу и глијалне ожиљке, што је густо накупљање ожиљног ткива које формира физичку и хемијску баријеру која спречава поправку нерава.
Када су оштећени органоиди третирани „плешућим молекулима“ – терапијом која је обновила кретање и поправило ткиво у претходној студији на животињама – резултати су били драматични. Повређено ткиво је произвело значајан раст неурита, што значи да су дугачка проширења која омогућавају неуронима да комуницирају поново почела да расте. Ткиво попут ожиљака је знатно смањено. Налази дају подршку идеји да би ова терапија, која је недавно добила ознаку за лек за сирочад од америчке Управе за храну и лекове (ФДА), могла да побољша опоравак људи са повредама кичмене мождине.
Студија је објављена 11. фебруара у Природно биомедицинско инжењерство.
„Један од најузбудљивијих аспеката органоида је то што их можемо користити за тестирање нових терапија у људском ткиву“, рекао је Самуел И. Ступп из Нортхвестерна, старији аутор студије и проналазач плесних молекула. „Осим клиничког испитивања, то је једини начин на који можете постићи овај циљ. Одлучили смо да развијемо два различита модела повреде у органоиду кичмене мождине човека и тестирамо нашу терапију да видимо да ли резултати подсећају на оно што смо претходно видели на животињском моделу. Након примене наше терапије, глијални ожиљак је значајно избледео да би постао једва уочљив, а поново смо видели да се неурити поново развијају. да наша терапија има добре шансе да делује на људима“.
Ступп је лидер у науци о регенеративним материјалима и носи титулу Професора Науке о материјалима и инжењерства, хемије, медицине и биомедицинског инжењерства у Одбору повереника на Нортхвестерн. Има именовања у Школи инжењерства МцЦормицк, Вајнберг колеџу уметности и науке и Медицинском факултету Фајнберг, и руководи Центром за регенеративну наномедицину (ЦРН). Први аутор рада је Нозому Таката, истраживач-доцент медицине на Феинбергу и члан ЦРН-а.
Зашто су људски органоиди важни
Органоиди се узгајају из индукованих плурипотентних матичних ћелија у лабораторији. Иако су поједностављене верзије пуних органа, они по структури, ћелијској разноликости и функцији веома подсећају на право ткиво. Због тога су органоиди моћни алати за проучавање болести, тестирање третмана и истраживање развоја органа. Они такође омогућавају истраживачима да се крећу брже и по нижој цени у поређењу са експериментима на животињама или клиничким испитивањима на људима.
Док су друге групе производиле органоиде кичмене мождине за проучавање основне биологије, овај модел представља велики напредак у истраживању повреда. Органоиди су имали неколико милиметара у пречнику и били су довољно зрели да издрже и моделирају трауматска оштећења.
Током неколико месеци, тим је водио матичне ћелије да формирају сложено ткиво кичмене мождине које садржи неуроне и астроците. Они су такође постали први који су укључили микроглију – имуне ћелије које се налазе у централном нервном систему – како би боље реплицирали инфламаторни одговор који следи након повреде кичмене мождине.
„То је нека врста псеудо-органа“, рекао је Ступ. „Ми смо први увели микроглију у људски органоид кичмене мождине, тако да је то било огромно достигнуће. То значи да наш органоид има све хемикалије које резидентни имуни систем производи као одговор на повреду. То га чини реалистичнијим, прецизнијим моделом повреде кичмене мождине.“
Шта су плесни молекули
Када су органоиди кичмене мождине у потпуности развијени, истраживачи су скренули пажњу на тестирање повреда и лечења. Први пут представљена 2021. године, терапија плесним молекулима користи контролисано молекуларно кретање да поправи ткиво и потенцијално преокрене парализу након трауматске повреде кичмене мождине. Припада широј класи супрамолекуларних терапеутских пептида (СТП), који се ослањају на велике склопове од 100.000 или више молекула да активирају ћелијске рецепторе и стимулишу природне сигнале за поправку тела. (Концепт супрамолекуларне терапије се такође користи у актуелним ГЛП-1 лековима за губитак тежине и дијабетес, област коју је Ступпова лабораторија истраживала пре скоро 15 година.)
Терапија се испоручује као течна ињекција која брзо формира мрежу нановлакна која подсећа на екстрацелуларни матрикс кичмене мождине. Прилагођавајући како се молекули динамички крећу унутар ове структуре, истраживачи су побољшали колико ефикасно комуницирају са ћелијским рецепторима који се стално мењају.
„С обзиром на то да су саме ћелије и њихови рецептори у сталном покрету, можете замислити да би молекули који се крећу брже чешће наилазили на ове рецепторе“, рекао је Ступ 2021. „Ако су молекули спори и нису тако „друштвени“, можда никада неће доћи у контакт са ћелијама“.
У претходним експериментима на животињама, једна ињекција дата 24 сата након тешке повреде омогућила је мишевима да поново ходају у року од четири недеље. Формулације са бржим молекуларним кретањем имале су бољи учинак од споријих верзија, што сугерише да повећано кретање повећава биоактивност и ћелијску сигнализацију.
Симулација трауме кичмене мождине
Да би тестирали терапију, истраживачи су створили два уобичајена типа повреде кичмене мождине у органоидима. Неки су исечени скалпелом да би опонашали рану сличну хируршкој рани. Други су били подвргнути повредама од компресивне контузије, упоредиве са траумом од озбиљне саобраћајне несреће или пада.
Обе врсте повреда довеле су до смрти ћелија и формирања глијалних ожиљака – баш као што се дешава код стварне повреде кичмене мождине.
„Могли бисмо да разликујемо астроците који су део нормалног ткива и астроците у глијалном ожиљку, који су велики и веома густо збијени“, рекао је Ступ. „Такође смо открили производњу протеогликана хондроитин сулфата, који су молекули у нервном систему који реагују на повреде и болести.“
Након третмана са плесним молекулима, скела од гелираних нановлакна смањила је упалу, смањила глијалне ожиљке, стимулисала екстензију неурита и подстакла неуроне да расту у организованим обрасцима.
Неурити укључују аксоне, који се често пресецају у повредама кичмене мождине. Када се аксони пресеку, комуникација између неурона је поремећена, што доводи до парализе и губитка осећаја испод места повреде. Промовисање поновног раста неурита могло би поново повезати ове путеве и помоћи у обнављању функције.
Улога молекуларног кретања
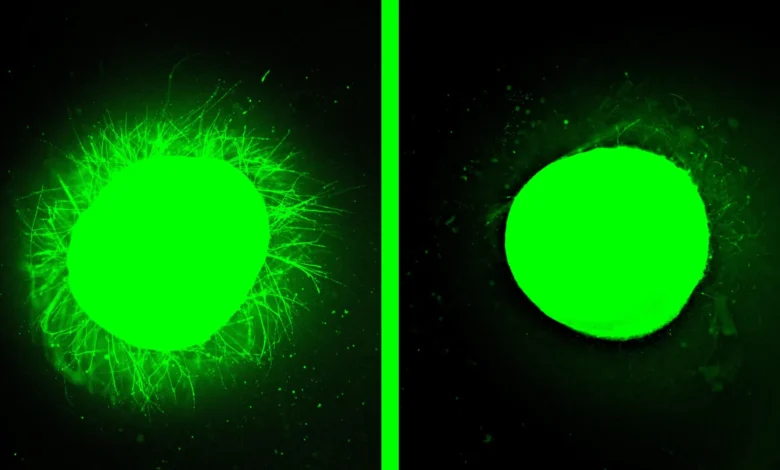
Ступп приписује ефикасност терапије супрамолекуларном кретању, што значи способност молекула да се брзо крећу и чак накратко одвоје од мреже нановлакна. Експерименти на здравим органоидима су ојачали ову идеју.
„Пре него што смо чак развили модел повреде, тестирали смо терапију на здравом органоиду“, рекао је он. „Молекули који плешу исплели су све ове дугачке неурите на површини органоида, али када смо користили молекуле који су имали мање или нимало покрета, нисмо видели ништа. Ова разлика је била веома жива.“
Гледајући унапред, тим планира да конструише још напредније органоиде како би побољшао своје моделе. Они такође намеравају да развију верзије које реплицирају хроничне, дуготрајне повреде, које обично укључују дебље и упорније ожиљно ткиво. Са даљим развојем, Ступп је рекао да би ове минијатурне кичмене мождине могле да допринесу персонализованој медицини генерисањем имплантабилног ткива из сопствених матичних ћелија пацијента, смањујући ризик од имунолошког одбацивања.
Студију, „Повреда и терапија у људском органоиду кичмене мождине“, подржао је Центар за регенеративну наномедицину на Универзитету Нортхвестерн и поклон породице Јохн Потоцснак за истраживање повреда кичмене мождине.