Током последње деценије, научници са Универзитета Нортхвестерн су идентификовали кључни увид у то како вакцине функционишу. Састојци су важни, али начин на који су ти састојци физички распоређени може драматично утицати на перформансе.
Након што су потврдили овај концепт у више студија, истраживачи су га применили на терапијске вакцине против рака које су усмерене на туморе изазване ХПВ-ом. У свом најновијем раду, открили су да једноставно прилагођавање оријентације и положаја једног пептида који циља на рак значајно ојачава способност имуног система да напада туморе.
Студија је објављена 11. фебруара Сциенце Адванцес.
Тестирање вакцине сферичне нуклеинске киселине
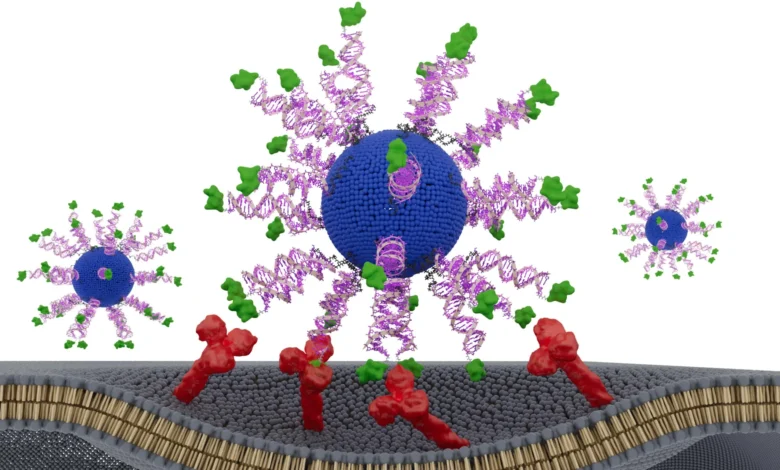
Да би истражио ову идеју, тим је направио вакцину направљену од сферичне нуклеинске киселине (СНА), глобуларне ДНК структуре која природно улази у имуне ћелије и активира их. Затим су намерно реорганизовали компоненте унутар СНА у неколико различитих конфигурација. Свака верзија је процењена на хуманизованим животињским моделима ХПВ-позитивног карцинома и у узорцима тумора узетим од пацијената са карциномом главе и врата.
Једна конфигурација је јасно дала врхунске резултате. Смањио је раст тумора, продужио преживљавање животиња и створио већи број високо активних Т ћелија које убијају рак. Налази показују да чак и мала промена у томе како су компоненте вакцине распоређене може одредити да ли нановакцина производи ограничен имуни одговор или моћан ефекат уништавања тумора.
Овај принцип чини основу поља у настајању познатог као „структурна наномедицина“, термин који је увео пионир нанотехнологије са северозапада Чед А. Миркин. Поље се усредсређује на СНА, које је Миркин измислио.
„Постоје хиљаде варијабли у великим, сложеним лековима који дефинишу вакцине“, рекао је Миркин, који је водио студију. „Обећање структуралне наномедицине је у могућности да из безброј могућности идентификује конфигурације које доводе до највеће ефикасности и најмање токсичности. Другим речима, можемо да направимо боље лекове одоздо према горе.“
Миркин је Георге Б. Ратхманн професор хемије, хемијског и биолошког инжењерства, биомедицинског инжењерства, науке о материјалима и инжењерства и медицине на Нортхвестерн-у. Запослен је на Вајнберг колеџу за уметност и науку, Школи за инжењерство МцЦормицк и Медицинском факултету Универзитета Нортхвестерн Университи. Он такође руководи Међународним институтом за нанотехнологију и члан је Роберт Х. Лурие Цомпрехенсиве Цанцер Центра Универзитета Нортхвестерн. Он је заједно са др Јоцхеном Лорцхом, професором медицине на Феинбергу и директором медицинске онкологије у Програму за рак главе и врата у Нортхвестерн Медицине, водио студију.
Померање даље од традиционалног приступа мешању вакцина
Конвенционални развој вакцине често укључује комбиновање кључних састојака без прецизне структурне контроле. У имунотерапији рака, молекули добијени из тумора који се називају антигени су упарени са имуностимулишућим једињењима познатим као адјуванси. Они се мешају заједно и дају као једна формулација.
Миркин ово описује као „приступ блендера“, где компоненте немају дефинисану организацију.
„Ако погледате како су лекови еволуирали у последњих неколико деценија, прешли смо од добро дефинисаних малих молекула до сложенијих, али мање структурираних лекова“, рекао је Миркин. „Вакцине против ЦОВИД-19 су прелеп пример – не постоје две исте честице. Иако су веома импресивне и изузетно корисне, можемо боље, а да бисмо створили најефикасније вакцине против рака, мораћемо.
Истраживања из Миркинове лабораторије показују да распоређивање антигена и адјуванса у пажљиво дизајниране структуре наноразмера може значајно побољшати резултате. Када су правилно конфигурисани, исти састојци могу дати јаче ефекте са мањом токсичношћу у поређењу са неструктурираним смешама.
Тим је већ користио ову структурну стратегију наномедицине да дизајнира СНА вакцине које циљају на меланом, троструко негативан рак дојке, рак дебелог црева, рак простате и карцином Меркелових ћелија. Ови кандидати су показали охрабрујуће резултате у претклиничким студијама, а седам лекова заснованих на СНА напредовало је у клиничким испитивањима на људима за различите болести. СНА су такође уграђени у више од 1.000 комерцијалних производа.
Јачање одговора ЦД8 Т ћелија на ХПВ карциноме
У новој студији, истраживачи су се фокусирали на карциноме узроковане хуманим папилома вирусом или ХПВ-ом. ХПВ је одговоран за већину карцинома грлића материце и све већи проценат карцинома главе и врата. Док превентивне ХПВ вакцине могу зауставити инфекцију, оне не лече рак који се већ развио.
Да би решио ову потребу, тим је креирао терапеутске вакцине дизајниране да активирају Т ћелије „убице“ ЦД8, најмоћније ћелије имуног система које се боре против рака. Свака наночестица је укључивала липидно језгро, имуноактивирајућу ДНК и кратак фрагмент ХПВ протеина који је већ присутан у туморским ћелијама.
Свака верзија вакцине је садржала идентичне састојке. Једина варијабла је била позиција и оријентација пептида или антигена добијеног од ХПВ-а. Истраживачи су тестирали три дизајна. У једном, пептид је био сакривен унутар наночестице. У друга два била је приказана на површини. За површинске верзије, пептид је био причвршћен или на Н терминусу или на Ц крају, суптилна разлика која може утицати на то како га имуне ћелије препознају и обрађују.
Верзија која је представила антиген на површини причвршћеном преко свог Н-краја произвела је најјачу имунолошку реакцију. Покренуо је до осам пута више интерферона-гама, важног антитуморског сигнала који ослобађају Т ћелије убице. Ове Т ћелије су биле знатно ефикасније у уништавању ХПВ-позитивних ћелија рака. У хуманизованим моделима мишева, раст тумора је значајно успорен. У узорцима тумора ХПВ-позитивних пацијената са раком, убијање ћелија рака се повећало за два до три пута.
„Овај ефекат није настао додавањем нових састојака или повећањем дозе“, рекао је Лорцх. „Дошло је од представљања истих компоненти на паметнији начин. Имуни систем је осетљив на геометрију молекула. Оптимизујући начин на који везујемо антиген за СНА, имуне ћелије су га ефикасније обрађивале.“
Редизајн вакцина против рака са прецизношћу и вештачком интелигенцијом
Миркин сада планира да преиспита раније кандидате за вакцину који су показали потенцијал, али нису успели да генеришу довољно јак имуни одговор код пацијената. Показујући да структура наноразмера директно утиче на имунолошку моћ, ово истраживање нуди оквир за побољшање терапијских вакцина против рака користећи постојеће компоненте. Та стратегија би могла убрзати развој и смањити трошкове.
Он такође предвиђа да ће вештачка интелигенција постати важно средство у дизајну вакцине. Системи машинског учења могли би брзо да анализирају огроман број структурних комбинација како би идентификовали најефикасније аранжмане.
„Овај приступ је спреман да промени начин на који формулишемо вакцине“, рекао је Миркин. „Можда смо пропустили савршено прихватљиве компоненте вакцине јер једноставно зато што су биле у погрешним конфигурацијама. Можемо се вратити на њих и реструктурирати их и трансформисати их у моћне лекове. Цео концепт структуралних наномедицина је главни воз који тутњи низ шине. Показали смо да је структура важна – доследно и без изузетка.“
Студију, „Постављање и оријентација Е711-19 диктирају одговор ЦД8+ Т ћелија у структурно дефинисаним сферним вакцинама нуклеинске киселине“, подржали су Национални институт за рак (број награда Р01ЦА257926 и Р01ЦА275430), Фондација Лефкофски Фамили Фоундатион са Универзитета Нортхерн Роберт Х.



