Молекуларни снимачи у реалном времену излажу унутрашњи живот ћелија


Илустрација: близанци пројекта
Ћелије су сиромашни приповједачи. Они живе сложени, догађајни животи – дели, мигрирајуће, реагујући на њихово окружење. Али до тренутка када дођу у лабораторију, без обзира на приповест да их је једном носио. Извукли су се из свог родног контекста и причвршћени су испод микроскопа или напукли отворен да бисте изложили генетску књигу изнутра, откривају само њихову коначну државу, а не пут који их је тамо водило. За ћелијске биологе, то је попут Глимпсинг-а финала игре и рад уназад да би закључио парцели.

Молекуларне баркоде откривају робучке ролете
Десетљећима су истраживачи натегнути да реконструишу ћелијске позадине кроз индиректно средство: статичке снимке, флуоресцентне отиске и алгоритамске закључке. Али то су форензички напори у најбољем случају, постављати мортисти несталих процеса.
Нова генерација алата за снимање ДНК-а обећава да ће то променити. Одржавањем ћелија са молекуларним еквивалентним рекордама лета, научници сада могу да се пријаве, у реалном времену, сигнали које ћелије добијају, стазе које путују и одлуке које доносе – све уносе неизбрисиво у генски мастило.
Ране верзије ових система снимања били су груби, способни да прате разграничење ћелијске судбине кроз циклусе дивизије, али мало друго. Уз напредак у геновним уређивањима и јединственим секвенцирајућим технологијама, међутим, ћелије сада могу и записати знакове које осећају, државе које прођу, па чак и време и интензитет сигнализационих догађаја и генске активности.
Истраживачи су користили ове алате за праћење развојних одлука у ембрионима миша, снимају генску активност у животињском мозгу и анализира експресију гена у конструисаним бактеријама док пролазе кроз црева. Ипак, то остају ране демонстрације, а истраживачка заједница је и даље фокусирана на проширење својих техничких могућности.
„Поље је насентно“, каже Рандалл Платт, генома инжењер у Швајцарском федералном институту за технологију (етх Цирих) у Базелу. „Постоје више примера концепата од случајева практичне употребе који су довели до биолошког или медицинског пробијања.“

Јаи Схендуре је помогао у покретању развоја уређаја за снимање ћелија као дипломског студента 2003. године.КРЕДИТ: РОН ВУРЗЕР / АП Слике за ХХМИ_ (2015)
Чак и тако, замах је изградња. Студије доказа концепта указују на потенцијал у стварном свету. И, потпомогнут свјежим улагањима, очекује се да ће темпо иновација убрзати. „Многе су нити су сазреле“, каже Јаи Схендуре, генома научник на Универзитету у Васхингтону у Сијетлу. Циљ сада, објашњава, да „притисне инжењеринг на следећи ниво“.
Једном оптимизовано и широко усвојено, Алати за снимање на бази ДНК могу претворити како научници проучавају развој, болест и ћелијско одлучивање у реалном времену. „Ако сада можемо инжењерски ћелије да снимамо на начине који су предвидљиви и програмибилни“, каже схондуре, „који само отвара све врсте граница.“
ДНК ДИАГИЕС
Сан о писању података у животног кода датуми датуми најмање до 2003. године, када је сход био студент МД-докторат на Харвард Медицинској школи (ХМС) у Бостону, Масачусетс. Те године, он и његов супервизор, генетичар Георге Црква поднели су патент за оно што су назвали „меморијске уређаје нуклеине киселине“: Примитивни систем снимања у бактеријама које су користиле „рекомбиназне“ ензиме за пребацивање сегмената ДНК напред и назад, попут прекидача за пребацивање.
Била је то амбициозна визија за складиштење молекуларних података – али једна ограничена технологијом времена. Чак и ако би концепт могао, у принципу, активност гена дневника, методе секвенцирања ДНК-а, а затим доступне да су протумачили записе споро и непрактично. „Било је прерано“, каже Црква. Требало је још једну деценију – и појаву секвенцирања следеће генерације, која је драстично продивала ДНК читање и смањила трошкове – пре првих молекуларних снимача који су могли да се изграде велике количине биолошких информација о трајним периодима.

Натуретецх Хуб
Синтетички биолог Тимотхи Лу, а затим на Массацхусеттс Институту за технологију (МИТ) у Цамбридгеу, предводио је набој, који приказује 2014. године колико су конструисане бактерије могле да претвори пролазне транскрипционе сигнале у промене ДНК. Упаривањем овог процеса израз ензима рекомбиназе, Лу и његове колеге створили су сталне генетске баркоде1. Две године касније, проширили су приступ за снимање идентитета различитих хемијских подражаја и редоследа у којем се јављају2.
Али ова стратегија убрзо је погодила зид. Сваки додатни меморијски – сваки транскрипцијски догађај, сигнализирајући знак или развојне одлуке – захтевао је сопствени изразит ензим који може да делује независно од осталих. И једноставно је било премало познатих рекомбиназа за ширење капацитета меморије на било који значајан начин.
Потребна је нова технолошка платформа – и стигла је у облик уређивања гена ЦРИСПР-ЦАС9.
У 2016. години, само неколико година након што је ЦрисПР прилагођен за уређивање људског ДНК, схренде је искористио алат да изазове серијске мутације на дефинисаним геномским локацијама, омогућавајући његовом тиму да би се евидентирала информације о линијима у сукцесивним круговима ћелијске дивизије на само неколико година. Схундера је искориштавао алат да изазове серијске мутације на дефинисаним геномским локацијама, омогућавајући његовом тиму да би се евидентирала информације о линији3. Познат као Гесталт (у уређивању гестата са синтетичким циљаним низовима за праћење линије), систем је састојао две компоненте: део ДНК-а инстриед са вишеструким циљевима ЦРИСПР-а; и ЦАС9 машине који су увели измене на тим веб локацијама (погледајте „Уређаји за снимање“).
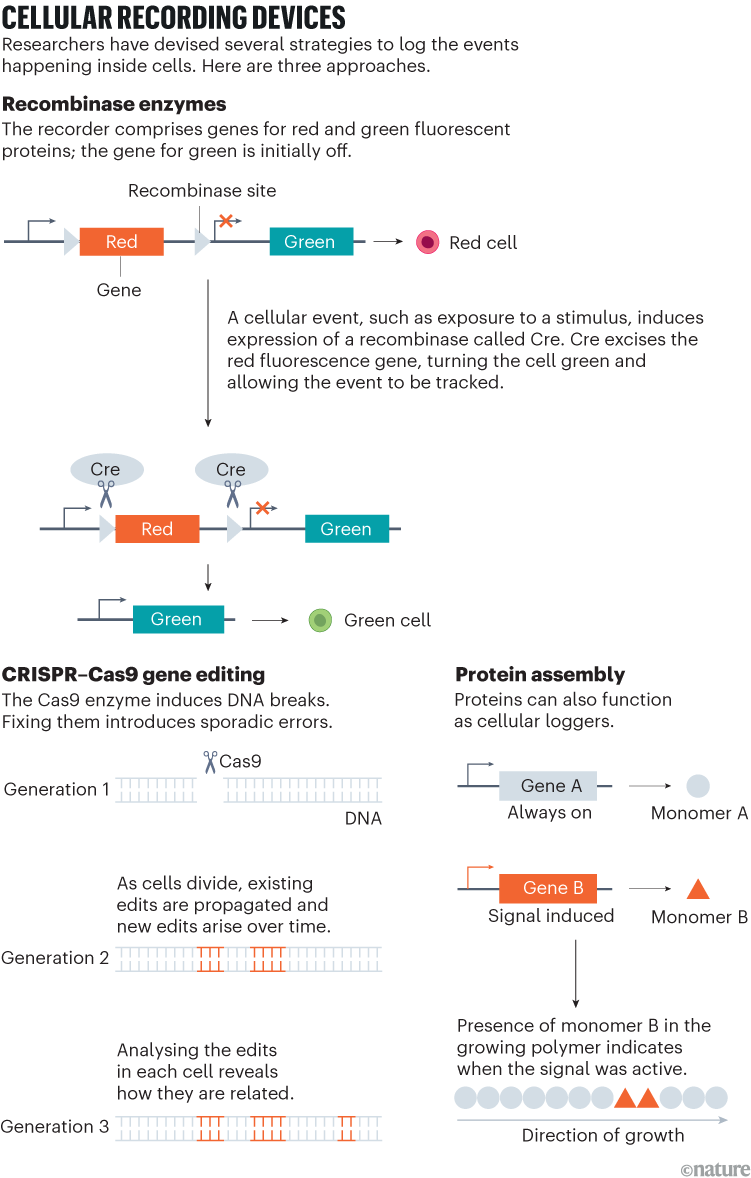
Како су ћелије подељене, посекотине су несавршено поправљене, остављајући јединствене баркоде који су се током времена акумулирали. Подешавањем ових развијајућих баркодова, истраживачи су могли да реконструишу мобилне стазе по ткивима или чак целим организмима – као свјесед и његове колеге, укључујући Аарон МцКенна, а затим дипломирани студент и сада генетичар од рака, а сада је генијела на медицини у Либанону, новом Хампсхире-у. Други су убрзо пратили одело са ЦрисПр-овим диктафонима за употребу у моделима миша и рака, постизање много већих капацитета меморије него са рекомбиназним системима и отварање свежих авенија за проучавање ћелијске динамике у развоју и болести.
Наоружани овим молекуларним мерилама, истраживачи су открили скривене руте за како се ћелије рака шире (познато као метастаза), као и увид у како се Цлонес рака проширује4. Развојни биолози, користећи сличне стратегије у ембрионалним мишевима, оспорили дугогодишњи погледи на формирање крви, откривајући популације ћелијског потомке који чине трајне доприносе у систем крви5. „Ниво детаља и резолуције које подржава је неспорна“ Куглање Сарах, развојни биолог на медицини Станфорд у Калифорнији, каже о Мишевима за праћење кризпрског заснованог на заснованом на Цриспр-у да је помогла у Пионеер-у.
Али Цриспр-ЦАС9 такође долази са компромисима. Будући да се ослања на двоструке паузе у ДНК, то може бити токсично за ћелије. И поновљено резање циљаних места може избрисати саме запис који је замишљен да сачува. Као резултат тога, иако Цриспр омогућава богатијим трагама са богатијим раним рекомбиназираним алатима, баркода које производи на крају засићене, упозорава ХМС синтетички биолог Саханд Хормоз. „Ако довољно избришете, онда је све избрисано – и немате никакав образац који можете да користите за реконструкцију стабла роба“, каже он.
Премијерно време
Та забринутост је гурнула поље према више-рафинираним стратегијама уређивања као што су основни уредници и, недавно, главни уредници, који преписују ДНК без да индукује паузе са двоструким слојем. Обоје су изграђене на оквиру ЦРИСПР-ЦАС, али уредни уредници замјењују један ДНК за другу позицију, премијери користе вођену реверзну транскриптажу да би у геному писали кратке прилагођене секвенце.
Ове уреднике наредне генерације гурају поље изван снимања ролине, омогућавајући прецизно евидентирање генског израза и сигнализационе динамике и оснаживање истраживача да би се евидентирало само да је догодио не само да је дошло до догађаја. „Прије, није било баш добар начин да се осете осећај шта се дешава у ћелији за уређивање генома,“ каже Јунхонг Цхои, синтетички биолог на центру рака Слоан Кеттеринг у Нев Иорку.
Обрасци модификација ДНК пружају „баркод“ за тражење ћелије
Сада, везујући се активност главних уредника за подстицајне промотере или транскрипционе склопове, истраживачи могу претворити пролазне молекуларне догађаје – као што су рафала експресије гена или интеракције протеина-протеина – у трајне промене ДНК-а. Штавише, ова врста геномске књиговодства може се паралелизовати да одговори на разнолике ћелијске сигнале, стварајући истовремено, хронолошке снимке молекуларне активности у врсти мултитрацк бакалне књиге, белешке Тхереса Ловелесс, синтетички биолог на Универзитету Рице у Хјустону, Тексас. „Та модуларност је права предност“, каже она.
Колективно, ови системи – доступни кроз складиште биолошког материјала Аддгене – представљају више него само паметне употребе генома уређивања. Они су софистицирани дизајн синтетичког биологије који интегришу фино подешене логичке склопове модуларним генетским компонентама: сензори за откривање ћелијских или еколошких знакова; актуатори на релејни улази; и писци да упишу информације у ДНК. „Закупни се многе компоненте манипулације синтетичких ћелија у ове сложене машине“, каже Сетх Схипман, биоенгинеер у Гладстоне Института у Сан Франциску у Калифорнији.
Ипак, чак и док ови алати постају снажнији и замршени, истраживачи и даље проналазе вредност у једноставнијим приступима – укључујући и врсту која ссушена и црква су прво замислила пре више од две деценије.
Прошле године биофизичар Харри МцНамара и његове колеге на Универзитету Принцетон у Нев Јерсеи-у користили су рекомбиназни систем за праћење активности кључних молекула сигнализационих молекула током раног развоја миша-ембриона. Ово је открило различите групе ћелија чија су молекуларна искуства у корелацији са својим евентуалним локацијама дуж предњег задњег задњег ембриона6. Био је то задатак за који су рекомбиназе биле добро прилагођене, јер је биолошко питање потребно само издржљиво да / не евидентирање сигнализационе активности, а не детаљне трупце које Алат заснован на Цриспр-у може да пружи, каже МцНамара, која је сада на Универзитету Иале у Новом Хавену.
„Дозвољено нам је да се заиста осврнемо на време и идентификујемо ове кључне тачке одлуке када ћелије одлуче, у смислу, где ће завршити“, каже он.
Флуоресцентно фокус
Нису сви продавани на ДНК као и универзални медиј за снимање, међутим.
БиоЕнгинеер Цхангјанг Лингху на Универзитету у Мичигену у Анн Сјеници, за један, фаворизује систем у којем се производи протеинских мономера у растућем супермолекуларном склопу као одговор на транскрипционе догађаје7. Ова стратегија најбоље функционише у ћелијама који нису раздијеле као што су неурони, јер су скупштине протеина разблажене током ћелијске дивизије. Али приступ такође нуди значајну предност: упаривањем флуоресцентне слике са протеинским ознакама специфичних за догађаје, истраживачи не могу да утврде не само када и колико је ген био активан, али и где се у ћелији догодио.
Већина платформи за снимање ДНК-а изгуби овај просторни контекст, јер секвенцирање захтева лизу ћелије, која уништава ћелијску архитектуру. Да се позабавимо овим, синтетичким биологом Амјадом агагом на Универзитету у Калифорнији, Лос Анђелеса, развио системе засноване на сликама који повезују флуоресцентне сигнале генетским баркодовама, омогућавајући његовом тиму да прати историју транскрипције у нетакнутим ткивима.8. Међутим, али, међутим, „то су нигде близу тако једноставне и прилагодљиве за лабораторије да раде као једноциклни редослед“, каже ага.




