Алзхеимерови лекови се коначно баве саме болести. Ево како
Алзхеимерова болест показала се да је шкакљива мета, а истраживачи и програмери на дроге деценијама траже ефикасне третмане. Расправе у бијеху над основним узроцима поремећаја, а различити приступи су се суочили са једном препреком за другим. Али поље је достигло прекретницу. У протекле четири године, америчка управа и лековна управа одобрила је неколико терапија која се баве неким потенцијалним биолошким коријенима стања, а не само ублажавајући симптоме – кључну научну прекретницу. Упркос напретку, међутим, још увек постоји дугачка листа отворених питања и толико посла да се уради.
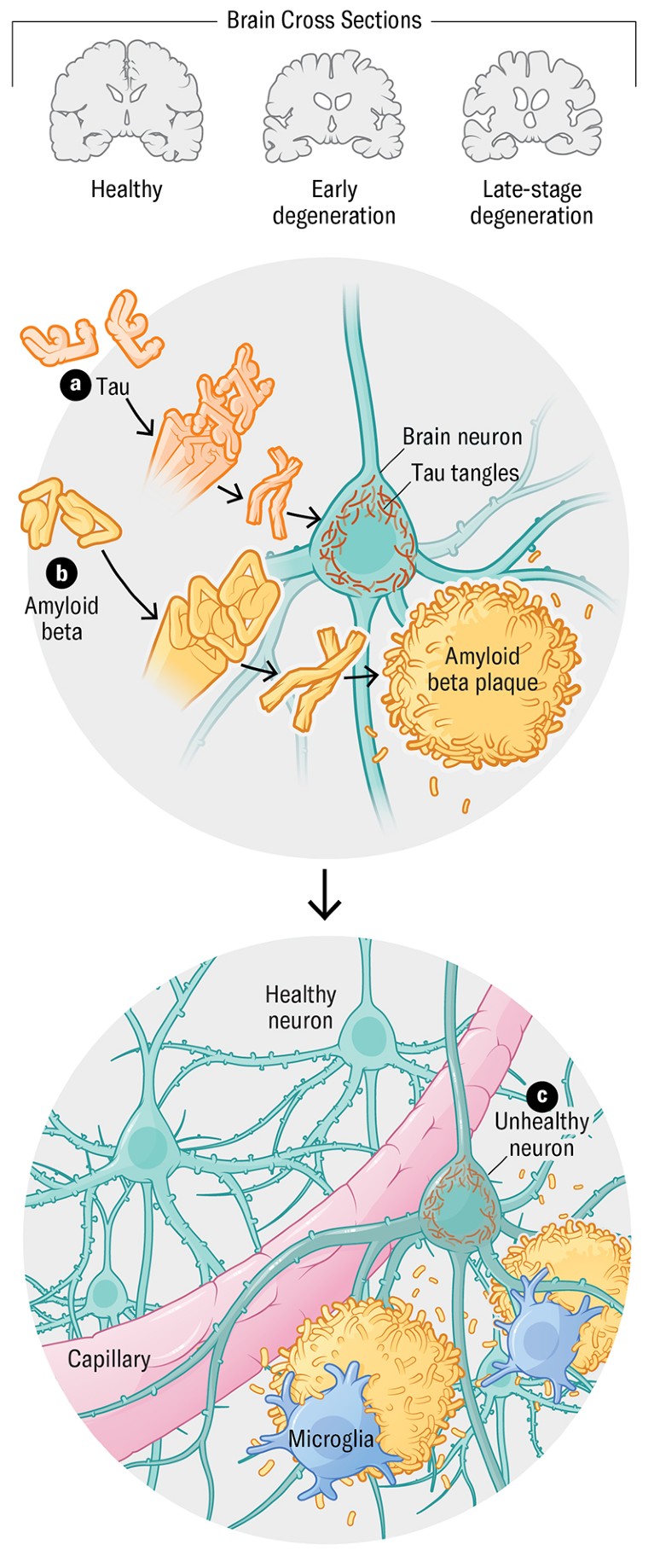
Мозак људи који умиру са Алзхеимеровом показују различита биологија: грудице или „плакете“ амилоидне бетонте протеине у размацима између неурона и запетљавања протеина Тау који се пре свега накупљају у нервним ћелијама. Једна превладавајућа теорија држи да се амилоид рано повећава, а Тау Танглес се развија када је у току оштећење нервних ћелија, али когнитивни симптоми још увек нису очигледни. Временом ови патогени или изазивајући болести, протеини поремети нервна комуникација ћелије. Најновији третмани – Леканемаб и донанемаб-везују се за амилоидне бетон протеине, очистите их из мозга и скромно спорог когнитивног пада.
Иновације у Алзхеимеровој болести
Али прогресија протеина повезаних од болести до стварне деменције је дугачка и нетачна, а амилоидни и Тау протеини накупљају и код људи са другим неуродегенеративним поремећајима. Помоћу Алзхеимера често постоји од 20 до 30 година између почетног откривања амилоидног и очигледног когнитивног пада. Према једној студији која је предвиђала ризик од болести на основу демографских података, стопе смрти и амилоидног статуса, мање од једне четвртине здравих 75-годишњих жена које тестирају позитивно на амилоиду у анализи кичмене течности или томографију мозга (ПЕТ) развоје алзхеимерове деменције током свог живота. Такви налази сугерирају да сам амилоид не предвиђа прогресију са вожњи и подстакнули су научнике да истражују друге стратегије.
Анализе ДНК секвенцирања идентификовале су генске варијанте које утичу на ризик Алзхеимера. Неки од ових гена указују на критичну улогу имуне активности и упале у процесу болести. Остала истраживања указује да је један начин смањења ризика од болести кроз промене начина живота. Према извештају 2024. године, скоро половина случајева деменције широм света би се могла спречити или одложити акцијама који се баве 14 модификованим факторима ризика, укључујући губитак слуха, физичку неактивност и васкуларне факторе ризика, као што су дијабетес и пушење (од којих и имунолошке активности и упале).
Основе
Познати Халлмарк оф Алзхеимерова болест је изградња Тау и амилоидне бетонте протеина у мозгу. Преко време Плакови и запетљани узрокују оштећење неурона и ћелијску смрт. Али већина Алзхеимерових пацијената је такође накупљала и друге протеине, као што су алфа-синуклеин, као и оштећење крвних судова које се могу појавити пре амилоидних плодова. Недавни докази сугерирају да упала, имуни процеси и фактори ризика васкуларни ризик такође играју кључну улогу у болести.
КРЕДИТ: Сада Медицински студији
Циљеви лечења
Постоји више од 100 текућих клиничких испитивања које тестирају разне интервенције, од којих свака циља једног или више потенцијалних доприноса деменцији. „Добићемо тамо у фазама“, каже Судха Сесхадри, неуролог и оснивачки директор Института Гленн БигГс за Алзхеимерове и неуродегенеративне болести у УТ Хеалтх Сан Антонио у Тексасу. „Амилоидни третмани за снижавање су део ње. Лекови имунолошког модулације вероватно ће бити део тога“, каже она. Такође ће бити важно да контролишете васкуларни ризик, додаје, која је „важна без обзира на то шта се дешава.“
Овде су наведени механизми који се овде сматрају кључним елементима Алзхеимеровог ризика:
Неуротрансмиттер рецептори Протеини на нервним ћелијским површинама које примају сигнале и играју критичну улогу у памћењу и учењу. Неки лекови за Алзхеимерову блоку штетне активности на овим рецепторима, а други повећавају активност спречавањем неуротрансмитера.
Амилоид Протеин који је, када је погрешно повезан, може да изгради изван нервних ћелија у мозгу и формира плакете који поремете неуронску функцију. Неколико терапијама имају за циљ да отеше ове депозите.
Упала и имуни процеси Они се могу активирати награђивање ненормалних облика амилоида и Тау у мозгу, што доводи до оштећења нервних ћелија и когнитивног пада.
Тау Протеин који обично помаже у одржавању структуре и облика ћелије. Може се изградити унутар неурона и формирати Танглес, који су ангалмарк алзхеимера, заједно са амилоидним плаковима. Неке нове терапије покушавају да циљају патолошке облике Тау, спречавајући ове агрегације ових протеина и унапређивање њиховог одобрења.
Синаптичка пластичност и неуропротекција Начини у којима мозак модификује везе између неурона током учења и меморије и штити неуроне од оштећења. Оба процеса се могу пореметити код особа са Алзхеимеровим.
Метаболизам Процес којим се мозак поквари храњиве материје. У Алзхеимеровим пацијентима, Скенирање кућних љубимаца показују ненормално ниски метаболизам глукозе у подручјима мозга важних за памћење и спознаје. Неке терапије имају за циљ да повећају метаболизам глукозе, који мозак треба за енергију.
Васкулатура Специјализовани крвни судови у мозгу формирају динамички интерфејс који је познат као баријера у крви, што помаже да се испоручи храњиве материје да нервирају ћелије и заштите мозак од патогена. Распад ове баријере повезано је са више неуродегенеративних болести, укључујући Алзхеимерове.
Фактори раста и хормони Протеини који могу заштитити ћелије мозга од оштећења и подстицати производњу нових ћелија. Неке терапије имају за циљ да их напуне и дају додатни слој заштите.
Епогенетски регулатори Протеини и други молекули који окрећу или искључују ген без промене основне ДНК секвенце. При томе, они могу утицати на нагомилавање погрешног амилоида, заглављеног ТАУ-а или других патогених протеина.
Неурогенеза Неурални раст. Оштећене нервне ћелије могу допринети оштећењу меморије и когнитивним падом људи са Алзхеимеровим. Промовисање раста нових нервних ћелија могло би вам помоћи да успори тај пад.
Оксидативни стрес Нездрав преоптерећење слободних радикала у односу на антиоксиданте у телу, што може наштетити нервним ћелијама и пореметити њихову функцију. Неке терапије имају за циљ да ослободе оксидативне штете унапређењем активности одређених ензима који неутралишу слободне радикале.
Протеостатис Процес који одржава одговарајуће преклопне, синтезу и разградњу протеина у ћелијама и може постати оштећен код људи са Алзхеимеровим. Неке експерименталне интервенције промовишу ћелијске путеве које спречавају загревање протеина или који олакшавају њихово уклањање.
Апое Скраћеница за Аполипопротеин Е, ген кодирања протеина који има три главна облика: ε2, ε3 и ε4. Апое ε4 је најјачи генетски фактор ризика за Алзхеимерове. Људи имају две копије или алеле, од Апое. Имати један Апое Ε4 Алеле може повећати нечији животни ризик од четвероструке око којом људи са две копије најчешћих варијанта, Апое ε3; двоје Апое Алелес ε4 могу повећати ризик до 25 пута. Људи са две Апое Ε3 Аллелес је вероватније 40 посто већа да ће развити Алзхеимерове од оних са једним ε3 и једним ε2.
Разне приступе лекова
Овај графикон укључује 138 лекова у 182 клиничке испитивања – Фармаколошка АЛЗХЕИМЕР-ова суђења у ЦлинициалТриалс.гов од јануара 2025. године. Иако нису свеобухватни (на пример, нису укључени све суђења засноване ван САД-а), датаСет пружа користан приказ велике слике. (Уредничка напомена: Суђења се фокусирала на вежбе, животни стил или неговатеља интервенције, когнитивне терапије у понашању, додаци, медицинска храна или терапије матичних ћелија такође нису укључене.) Суђења су груписана према заједничком механизму деловања на левој страни (циљеви лечења) и терапијским циљевима са десне стране. Пите графикони показују колики проценат сваке категорије лекова у фази 1, фаза 2 и фазна 3 суђења. (Дрога у 3. фази 3 суђења се углавном ближи ФДА одобрењу од фазе 1.) Неуротрансмиттер рецептори, амилоид и упала су тренутно најчешће циљани механизми. Најпопуларнија терапијска категорија је дрога која циља на болести – у којем је циљ успоравање клиничког пада фокусирањем на молекуле и телесне системе. Лијекови који циљају симптоми, насупрот томе, насупрот томе да побољшају мерљиве симптоме који су већ присутни на почетку лечења.
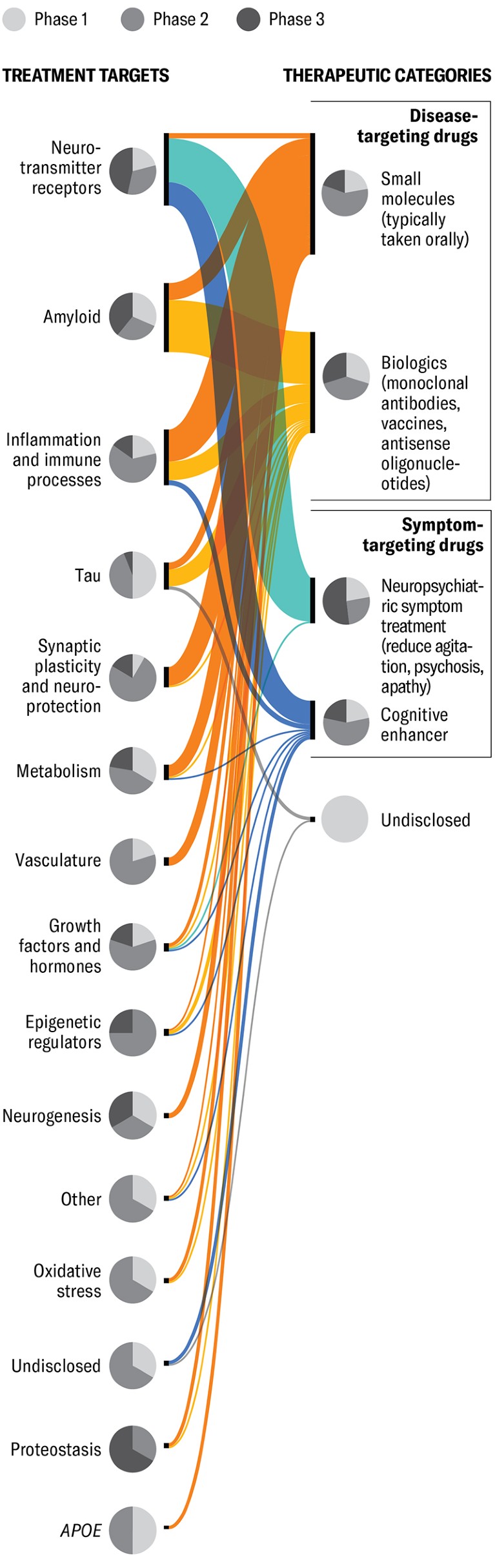
КРЕДИТ: Јен Цхристиансен. Извор: „Алзхеимер’с Болест Развој дроге на цевоводу: 2025,“ од Јеффреи Л. Цуммингс ет ал. у Алзхеимер’с & Дементиа: Транслациона истраживања и клиничке интервенцијеВол. 11; Април-јун 2025 (подаци)
Интервенција студија случаја
Док су лекови који циљају протеине Амилоид и Тау, привукли су тешку пажњу и финансирање, други терапијски приступи су се фокусирали на друге биолошке механизме у Алзхеимеровој болести. Примери последње групе су описани у даљем тексту.
Упала Задржавање нервних ћелија здравих и заштита од оштећења захтева равнотежу између растворљивих и мембранских облика протеина који се зове ТНФ-α. У условима имуне дисфункције, пораст растворљивог ТНФ-α поремети здраву равнотежу или хомеостазу и покреће упалу. Једна компанија (Инмуне Био) развија лек који се веже и деактивира растворљиво ТНФ-α, враћање ефеката промоције здравља трансмбране.
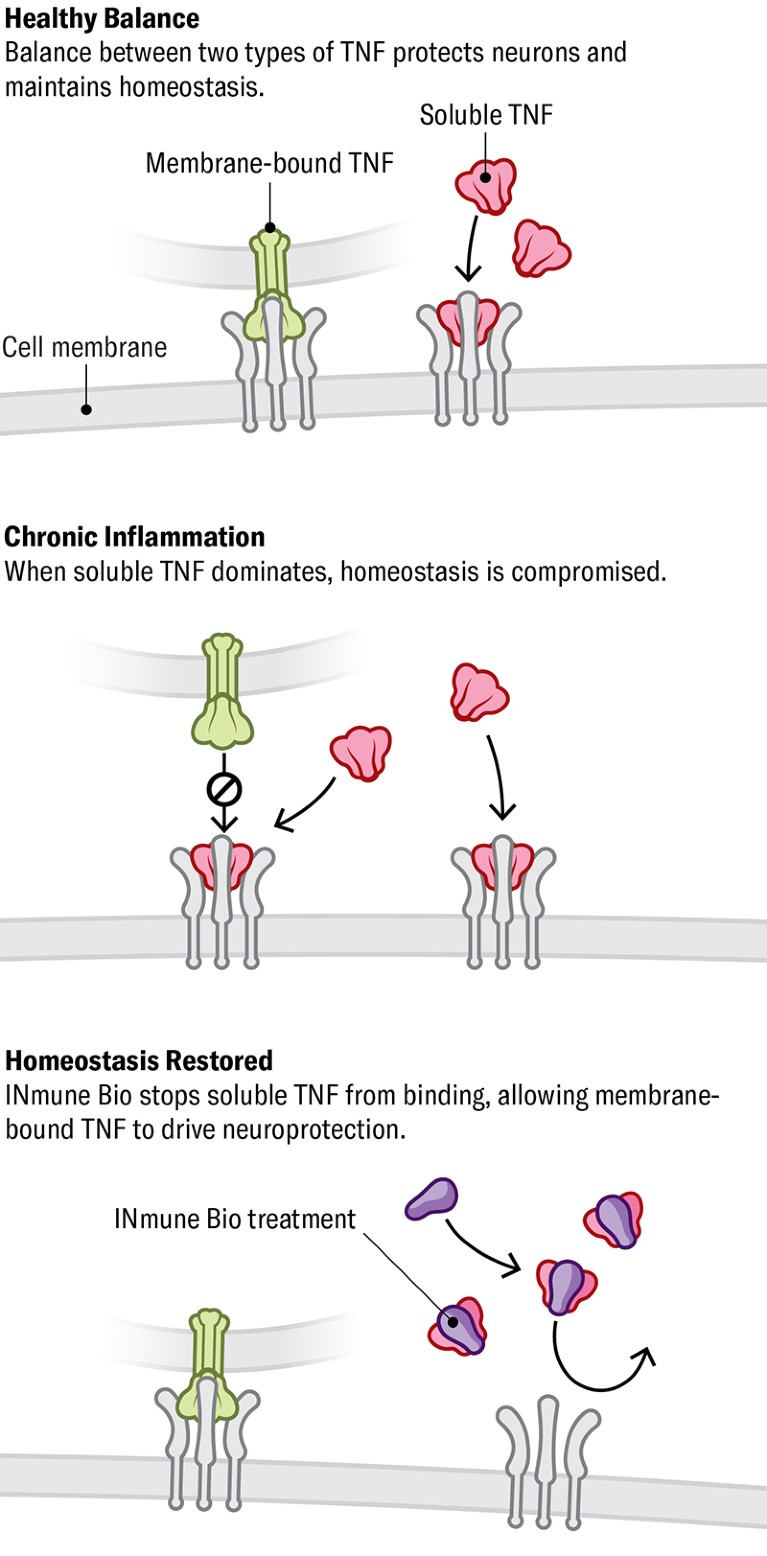
КРЕДИТ: Сада Медицински студији
Метаболизам Инсулин, хормон који регулише доступност енергије и комуникацију мозга, такође помаже у одржавању имунолошког и васкуларног здравља. Клиничко испитивање на челу са Сузанне Црафт-а Факе Форест Университи Сцхоол оф Медицински је интраназална испорука инсулина и лека од дијабетеса и на лекове на дрогу у људе са раним алзхеимеровим или благим когнитивним оштећењем.
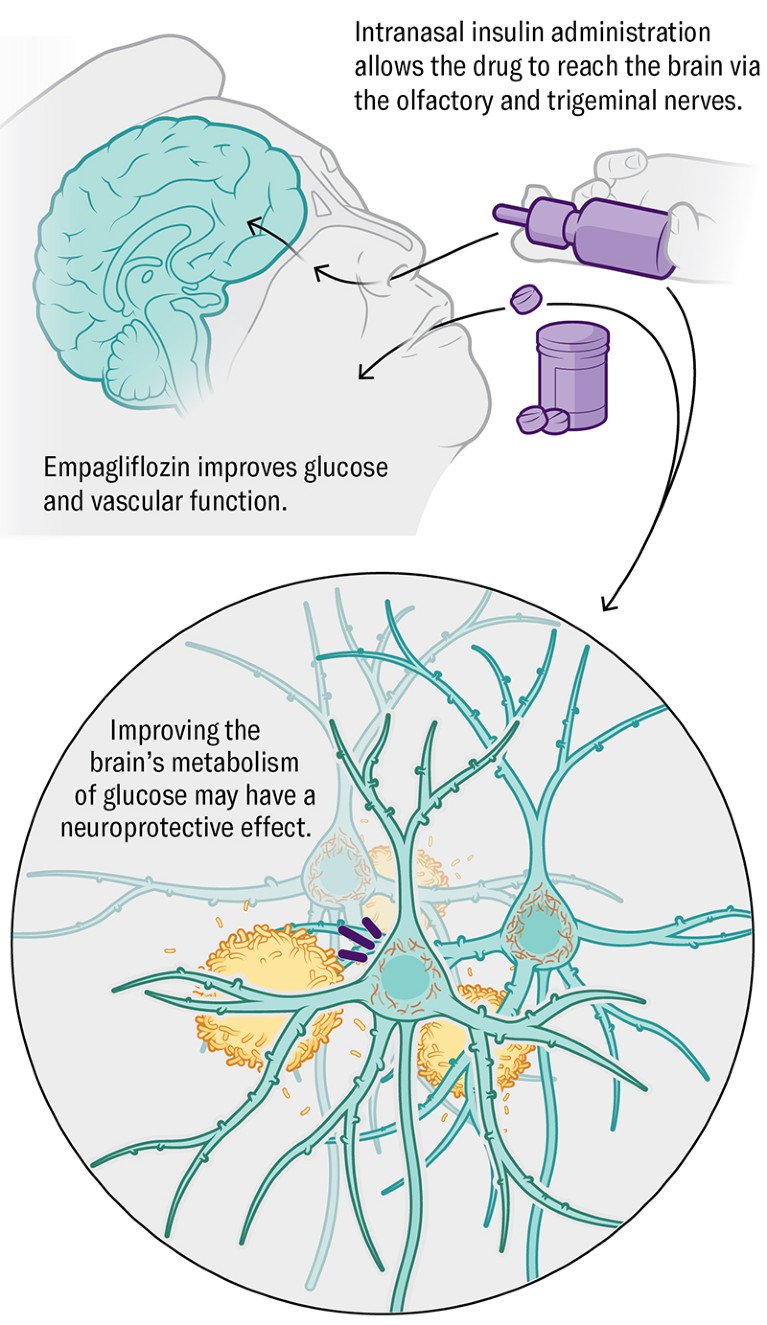
КРЕДИТ: Сада Медицински студији
Васкулатура Неколико компанија развија нове верзије амилоидних антитела која може ефикасније продрети на мозак, на пример, Роцхеов Тронтинемаб. Најмање једна компанија, Неуваск, развија ранију интервенцију с фазе која циља се само васкулатуру, да тестира да ли је мање непропусна крвно-мозак баријера могла успорити напредовање болести.
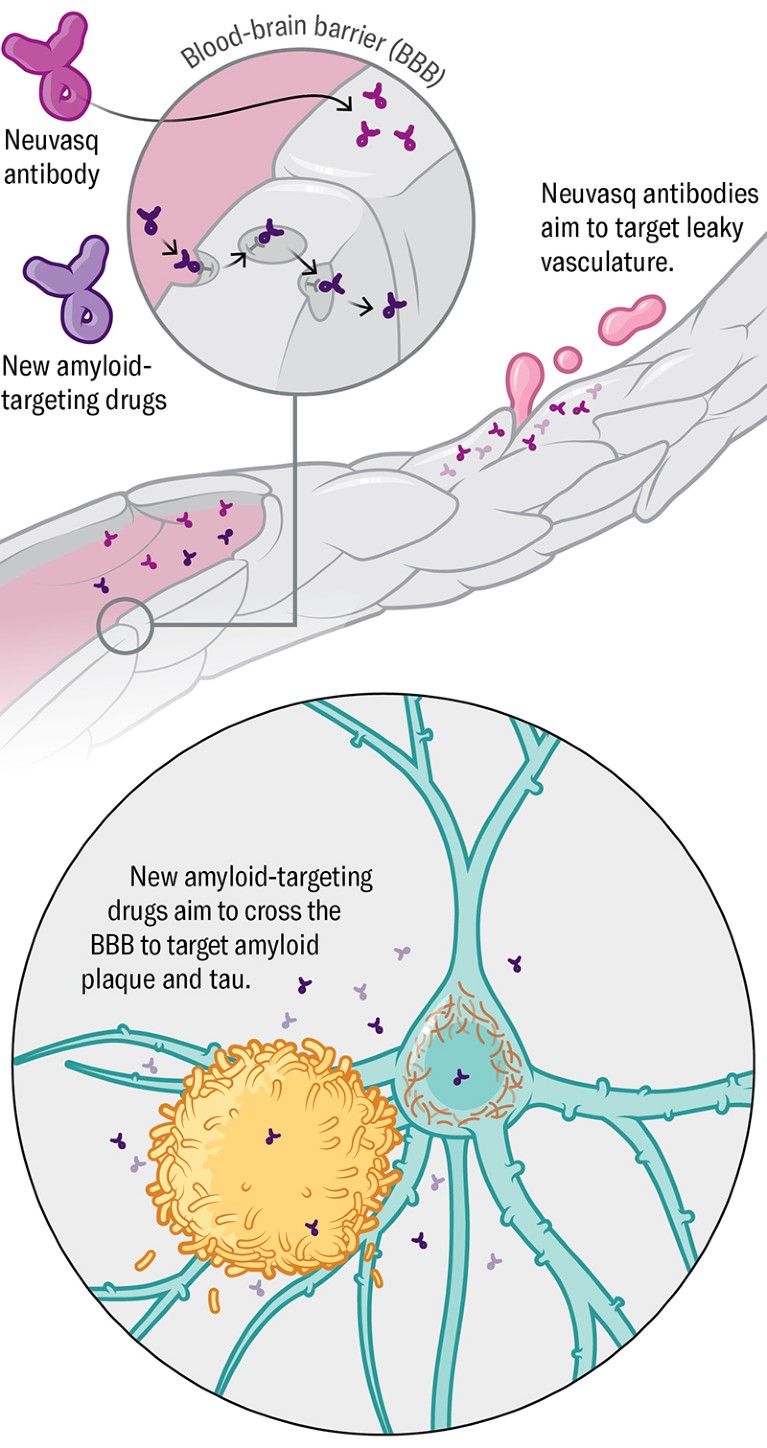
КРЕДИТ: Сада Медицински студији
Апое Неке терапијске стратегије имају за циљ да смање или се ослободе Апое ε4 варијанта ризика, повећати производњу протеина од стране заштитног ормара гена, Апое ε2 или уређивање Апое ε4 ген до Апое ε2 верзија. У малој студији генске терапије, Лекео Терапеутицс је користио модификоване вирусе да би испоручили Апое ε2 ген у кичмену течност од 15 алзхеимерових пацијената који су имали опасније Апоеε4 варијанта.
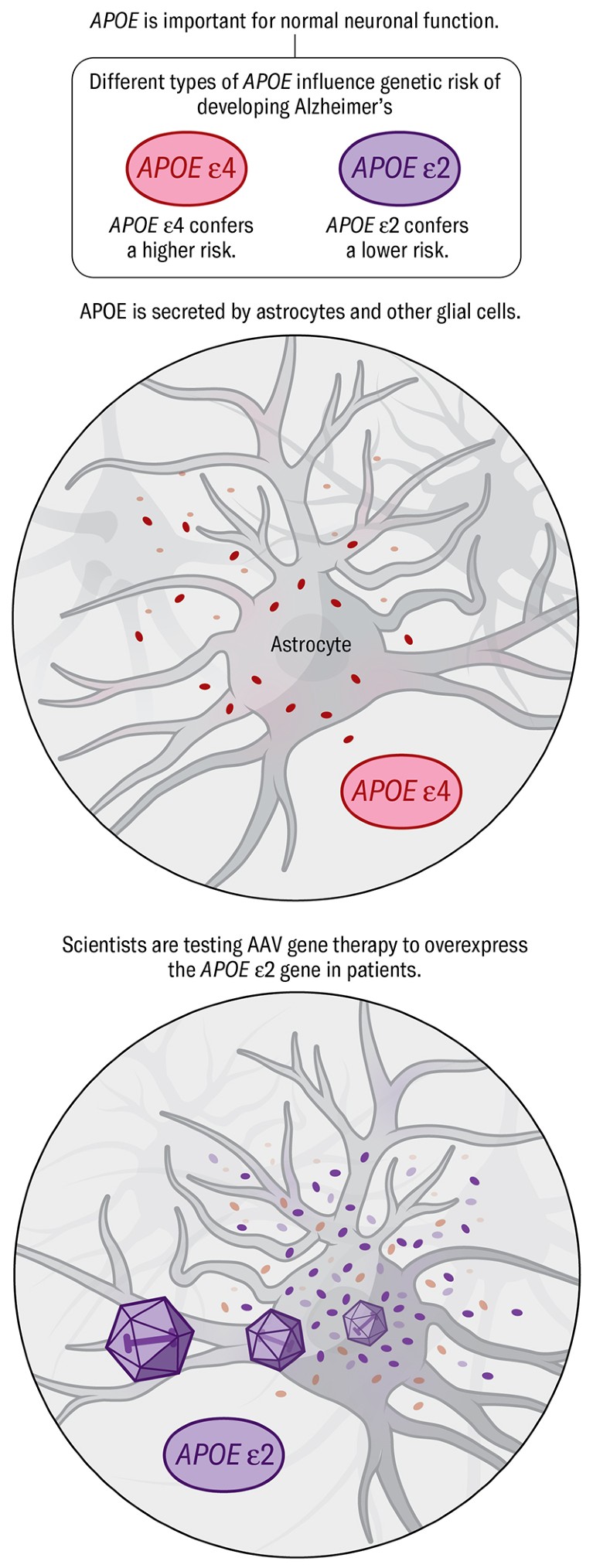
КРЕДИТ: Сада Медицински студији




